
Wenn man versucht, die Photovoltaik zu verstehen, wird man immer wieder mit Begriffen aus der Atomphysik und Kernphysik konfrontiert, die wichtig sind, um die Vorgänge in der Solarzelle nachzuvollziehen.
Deshalb finden Sie hier eine Liste und Erklärung der unterschiedlichen Atommodelle. So lassen sich die Phänomene, die dem Photoelektrischen Effekt zu Grunde liegen, einfacher greifen.
Was ist ein Atommodell?
Ein Atommodell ist eine konzeptionelle Darstellung der Struktur und Zusammensetzung eines Atoms. Es beruht auf den Ergebnissen experimenteller Untersuchungen. Aber jedes Modell ist immer nur so gut, wie die Vorhersagen, die es machen kann.
So wurden Atome früher als starre, homogene Kugeln betrachtet. Spätere Untersuchungen zeigten jedoch, dass Atome eine innere Struktur besitzen und sich in weitere Komponenten aufteilen. Deshalb wurden über die Jahre verschiedene Atommodelle entwickelt.
Obwohl diese Modelle weitgehend durch die moderne Quantenmechanik ersetzt wurden, sind sie immer noch hilfreich zum Verständnis der Prozesse in Solarzellen und erklären die Entwicklung des wissenschaftlichen Denkens über Atome. Deshalb werden Sie hier im Detail vorgestellt.
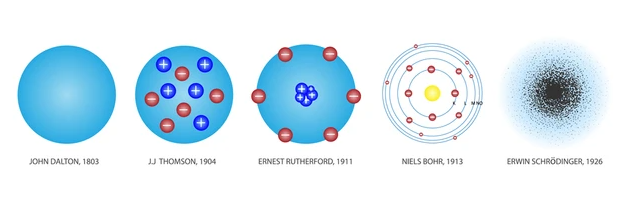
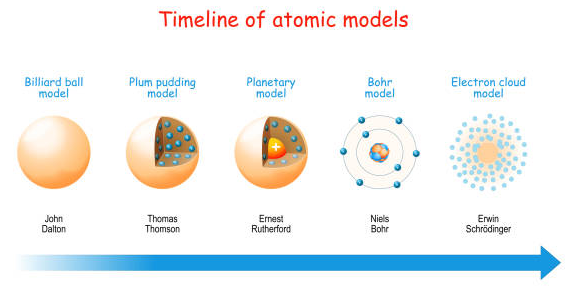
Daltons Atommodell – Kugelmodell
John Dalton, ein britischer Wissenschaftler, stellte 1803 das nach ihm benannte Atommodell vor, das auch als „Kugelmodell“ bekannt ist. Hier sind einige wichtige Punkte seines Modells:

- Elemente bestehen aus winzigen, unteilbaren Teilchen, die als Atome bezeichnet werden, sie können nicht weiter geteilt werden.
- Alle Atome eines gegebenen Elements haben identische Massen und Eigenschaften. Die Atome unterschiedlicher Elemente haben unterschiedliche Massen und Eigenschaften.
- Es gibt genauso viele Atomarten wie es Elemente gibt.
- Atome sind unveränderlich. Bei chemischen Reaktionen werden werden keine Atome geschaffen, zerstört oder in andere Arten von Atomen umgewandelt.
- Bei chemischen Reaktionen werden die Atome neu angeordnet und sie kombinieren sich in einfachen Verhältnissen, um neue Stoffe zu bilden.
Daltons Modell war ein entscheidender Fortschritt in der Chemie, weil es dazu beitrug, die Gesetze der Erhaltung von Masse und konstanten Proportionen zu erklären, die zeigen, dass Masse in chemischen Reaktionen erhalten bleibt und dass Elemente immer in den gleichen Proportionen miteinander reagieren, um eine spezifische Verbindung zu bilden.
Obwohl Dalton’s Atommodell die Basis für das moderne Verständnis der chemischen Reaktionen legte, war es in einigen Aspekten ungenau:
- Atome sind sehr wohl weiter teilbar. Sie bestehen aus Elektronen, Protonen und Neutronen.
- Sie können bei Kernfusion bzw. Kernspaltung entstehen oder zerfallen.
- Es gibt zu den Elementen verschiedene Atomsorten die unterschiedlich schwer sind (Isotope).
Um diese Tatsachen zu verstehen waren komplexere Modelle notwendig.
Thomson- oder „Rosinenkuchen“-Modell
Atome sind elektrisch neutrale Gebilde, die aber Elektronen enthalten müssen, wie sich zum Beispiel durch die Elektrolyse beweisen lässt. Deshalb stellte sich J.J. Thomson Anfang des neunzehnten Jahrhunderts das Atom als ein hochelastisches Klümpchen in der Größenordnung von 10-10 m vor.
Bei diesem sogenannten Thomson-Modell wird das Atom als homogene Masse betrachtet, die aus positiver Ladung besteht. In diese Masse sind Elektronen eingebettet, ähnlich wie Rosinen in einem Kuchenteig – deshalb wird dieses Modell auch Rosinenkuchen-Modell genannt.
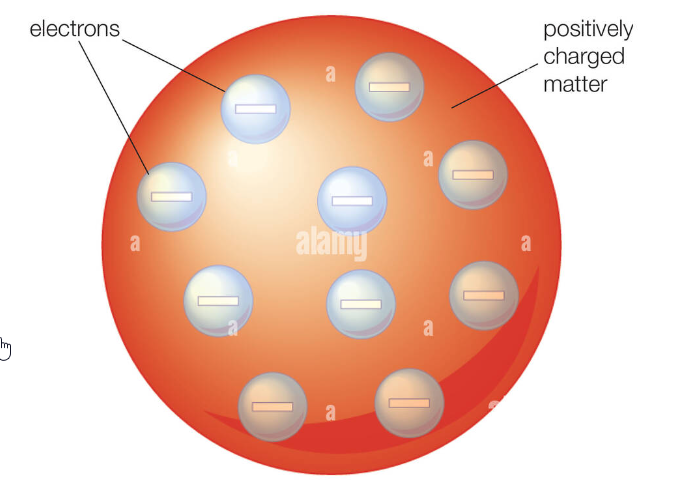

Durch dieses Modell wurden die mechanischen und thermischen Eigenschaften des Atoms fast vollständig beschrieben. Es konnte jedoch die Ergebnisse von Rutherfords Streuversuchen nicht erklären.
Das Rutherfordsche Atommodell
Doch auch das Thomson-Modell konnte nicht alles erklären. Bei den Streuexperimenten von Ernest Rutherford (auch als Goldfolienexperimente bekannt) wurden α-Teilchen (positiv geladene Teilchen, die aus Heliumkernen bestehen) auf eine dünne Goldfolie geschossen und die Streumuster der durch die Folie hindurchgehenden Teilchen beobachtet.
Wenn das damals akzeptierte Thomson-Modell korrekt gewesen wäre, hätten die α-Teilchen die Goldatome mit minimaler Ablenkung passieren sollen, da im Thomson-Modell das positive Ladungsfeld im Atom gleichmäßig und weit verteilt ist.
Die Experimente zeigten jedoch, dass ein kleiner Prozentsatz der α-Teilchen in großen Winkeln abgelenkt wurde, einige sogar um fast 180 Grad.
Auf der Grundlage dieser Ergebnisse schlug Rutherford ein neues Atommodell vor. In diesem Modell besteht das Atom hauptsächlich aus leerem Raum mit einem sehr kleinen Kern im Zentrum, dessen Radius nur etwa 10-14 m beträgt.
Dieser Kern enthält positive Elementarladungen sowie fast die komplette Masse des gesamten Atoms.
Diese Größe passt aber nicht mit der Beobachtung zusammen, dass das Atom mechanisch und thermisch so erscheint als hätte es eine Größe von 10-10 m. Deshalb blieb nichts anderes übrig, als eine negativ geladene Hülle aus freischwebenden Elektronen zu postulieren, die den Kern in entsprechendem Abstand umgibt.
Dabei entspricht die Anzahl Elektronen in der Hülle auch der Kernladungszahl Z, welche gleichzeitig die Ordnungszahl des Elements im Periodensystem festlegt. Zum Beispiel hat Wasserstoff, das leichteste Element, nur ein Elektron und damit die Ordnungszahl 1.
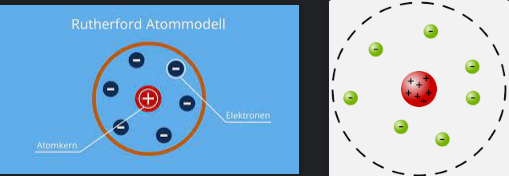
Es ist wichtig zu bemerken, dass obwohl das Rutherford-Modell ein großer Fortschritt war, es immer noch Probleme mit sich brachte.
So war bekannt, dass alle Atome mit derselben Ordnungszahl von außen gleich aussehen. Um das zu erreichen, müssten sich die Elektronen bei jedem Atom in derselben Entfernung zum Kern aufhalten. Es schien aber keinen logischen Grund zu geben, warum die Elektronen einen bestimmten Abstand zum Kern einhalten sollten.
Wenn wir herauszoomen und unser Sonnensystem von außen ansehen, ist immerhin auch jeder vorstellbare Bahnradius möglich, solange der Körper auf dieser Bahn um die Sonne eine entsprechende Geschwindigkeit besitzt.
Ein weiteres Problem beim Rutherford-Modell ist die Notwendigkeit, dass die Elektronen sich um den Kern herumbewegen, um seiner anziehenden Wirkung zu widerstehen (eben genau wie die Planeten in unserem Sonnensystem).
Allerdings gibt ein beschleunigtes Elektron, den Gesetzen der Elektrodynamik folgend, immer auch Strahlung in Form von Energie ab. Durch die sich ständig verringernde Energie müsste das Elektron also innerhalb weniger Nanosekunden in den Kern fallen und dabei einen Lichtblitz emittieren. Das passiert aber nicht.
Deshalb bedarf es eines ausgefeilteren Modells, um die Stabilität von Atomen zu erklären und auch, um korrekte Vorhersagen darüber zu machen, wie Atome Licht absorbieren bzw. emittieren. Das gelang erst durch die Quantenmechanik und das Bohrsche Atommodell.
Das Bohrsche Atommodell – Schalenmodell
Niels Bohr entwickelte das Rutherfordsche Modell weiter, um das Problem der Atomstabilität zu lösen. Bei seinem sogenannten Schalenmodell können sich die Elektronen nur auf Schalen mit einer festen Entfernung zum Kern bewegen. Jede Schale steht für einen Energiewert und kann nur eine bestimmte Zahl von Elektronen beherbergen.
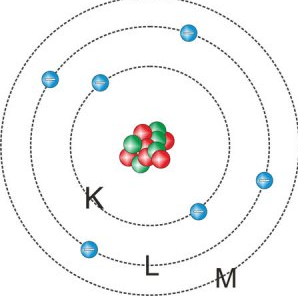
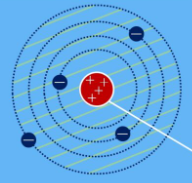
Für dieses Modell legte er folgende Postulate fest:
- Atome können nur bestimmte Energien annehmen, d.h. die Elektronen bewegen sich auf festen Bahnen. In diesen erlaubten Energiezuständen strahlt das Atom nicht.
- Strahlung kann nur beim Übergang zwischen diesen Zuständen in diskreten (ganzzahligen) Werten emittiert oder absorbiert werden. Die Frequenz dieser Strahlung hängt ausschließlich von der Energiedifferenz der beiden Schalen ab, zwischen denen das Elektron springt (Quantensprung zwischen zwei stationären Zuständen).
Diese beiden Postulate stehen im krassen Widerspruch zur klassischen Physik, deshalb gibt es noch ein drittes Postulat, um einen fließenden Übergang zur Quantenmechanik zu schaffen, das würde aber an dieser Stelle zu weit führen.
Wichtig ist, dass die sogenannte Quantisierung der Bahnradien und der Energien ein Durchbruch war, der es ermöglichte, das Linienspektrum für das Wasserstoffatom theoretisch zu deuten und wesentliche Züge des Periodensystems der Elemente zu klären.
Auch mit diesem Modell ist man noch nicht „fertig“, der Vollständigkeit halber wollen wir die Quantenmechanik noch ganz kurz anreißen.
Das Quantenmechanische Atommodell – Orbitalmodell
Die weiterhin bestehenden Schwierigkeiten des Bohrschen Modells wurden erst mit der Entwicklung der Quantenmechanik gelöst. Diese Theorie beruht auf dem Welle-Teilchen-Dualismus der Materie, d.h. Licht, Elektronen und andere mikroskopische Objekte können sowohl Teilchen- als auch Wellencharakter annehmen.
Das Orbitalmodell stellt dabei das aktuellste Atommodell dar. Hier werden Elektronen nicht als Teilchen auf bestimmten Bahnen angesehen, sondern vielmehr als Wellen betrachtet, die sich mit bestimmten Wahrscheinlichkeiten in dreidimensionalen Räumen um den Kern aufhalten.
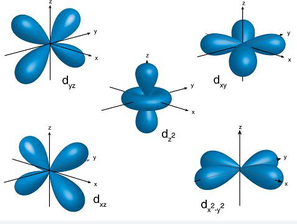
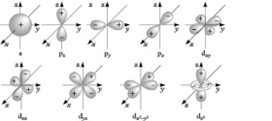
Jedes dieser sogenannten Orbitale hat eine bestimmte Form und Größe, die von der Energie des Elektrons und seinem Drehimpuls abhängt. Diese Orbitale werden oft als Wolken um den Kern dargestellt und zeichnen eine Wahrscheinlichkeitsverteilung für den Ort, an dem die Elektronen zu finden sind.
Wir sprechen an dieser Stelle immer nur von Aufenthaltswahrscheinlichkeiten, weil hier die Heisenbergsche Unschärferelation zum Tragen kommt. Sie besagt, dass eine gleichzeitige Aussage über den Ort und den Impuls von Teilchen immer mit einer Unbestimmtheit behaftet sind.
Dieses Modell bietet eine genauere Beschreibung vieler atomarer Eigenschaften, einschließlich der chemischen Bindungen zwischen Atomen und der Struktur des Periodensystems der Elemente.
Fazit:
Durch die verschiedenen Atommodelle lassen sich nicht nur die historischen Entwicklungen der Physik, sondern auch die Eigenschaften der Atome besser einordnen. Durch dieses Verständnis wird es leichter, komplexere Phänomene wie Halbleiter und den Photoelektrischen Effekt zu verstehen.
Kurz gesagt:
Zum besseren Verständnis der physikalischen Abläufe in Solarmodulen ist es wichtig, die unterschiedlichen Atommodelle zu kennen und zu verstehen. Am wichtigsten ist dabei das Bohrsche Atommodell, in dem sich die Elektronen auf festen Schalen um einen kleinen und massereichen Kern bewegen. Strahlung entsteht nur, wenn Elektronen zwischen zwei dieser Schalen springen.
Nachgefragt:
Welches Atommodell ist richtig?
Jedes Modell ist nur so gut, wie die Menge der korrekten Vorhersagen, die es machen kann. Je komplexer das Modell, desto genauer gewöhnlich seine Vorhersagen, aber desto schwieriger ist es gewöhnlich auch zu verstehen. Dabei entspricht ein Modell niemals zu hundert Prozent der Realität, sonst wäre es kein Modell mehr.
Deshalb ist keins der hier genannten Atommodelle tatsächlich „richtig“. Jedes hat seine Vor- und Nachteile, um die Realität vorherzusagen. Dabei liefert das aktuellste Modell in den meisten Fällen auch die besten Vorhersagen. Allerdings reicht für die das Verständnis der Photovoltaik das Schalenmodel von Bohr fast vollständig aus. Lediglich eine Erweiterung Bändermodell macht Sinn.
Wofür braucht man Atommodelle?
Um das Bändermodell zu verstehen, das die Grundlage des photovoltaischen Effekts bildet, ist es notwendig zumindest das Schalenmodell von Bohr zu begreifen.
Was war das erste Atommodell?
Wenn man es genau nimmt, gab es bereits in der Antike ein erstes Atommodell. So nahm Demokrit an, dass Atome die kleinsten Bausteine der Materie sind. Das Wort Atom leitet sich vom griechischen Wort atomos ab, und bedeutet so viel wie „unteilbar“. In seiner Vorstellung hatte jedes Atom die Form eines regelmäßigen geometrischen Körpers, wie Kugel, Zylinder, Pyramide, Würfel.

Schreibe einen Kommentar